IR情報
FAQ
基本情報
- 社名の由来を教えてください。
-
創業者は腎臓内科医ですが、創業当初には腎臓病の治療薬は極めて少ない状況でした。当社は、腎臓病の治療薬の開発を目標に掲げて創業されたため、「腎臓(renal)の科学(science)」という意味でレナサイエンス(Renascience)と名付けられました。また、レナサイエンスは、「ルネッサンス(復興)、renascence」の意味を兼ねています。
医薬品は必ずしも必要な医療分野で開発されているわけではなく、腎臓病のように開発が困難な領域(有効性の評価に時間がかかるため実施が困難)や希少疾患(患者数が少ない疾患で売上が少ない)での医薬品開発は遅れています。そこで、現在当社は、開発が困難な領域や希少疾患での医薬品開発に積極的に取り組んでいます。
- 事業拠点はどこですか。
-
本社は宮城県仙台市です。研究開発拠点は東北大学大学院医学系研究科メディシナルハブ(宮城県仙台市青葉区星陵町2-1 医学部5号館)です。
- 多様なモダリティ(治療手段の種類)を開発する理由は何ですか。
-
当社は医療課題を解決し、ヒトが心身共に生涯にわたって健康を享受できるための新しい医療を創造したいと考えています。特定の技術に特化したベンチャーではないので、モダリティは特に問いません。
医薬品産業は、低分子医薬品を中心とした開発から、バイオ医薬品へと多様化しつつあります。さらに、近年の工学系や情報系技術の進歩により、情報・工学技術との融合による新たな医療の模索も進んでおり、欧米や国内の大手製薬企業では既に医薬品単体のビジネスから医療ソリューション全般にわたるビジネスへの転換を迎えております。医薬品、医療機器、さらには人工知能(AI)を活用したプログラム医療機器やアプリなど、医療での治療オプションも広がりつつあります。
そのため、これまでの当社の主体である化学系や生物系の研究に加えて、工学系や情報系の研究にも視野を広げ、多彩で魅力ある研究と事業のポートフォリオを創出したいと思います。
- どんな医療課題に取り組んでいますか。
-
世界保健機関(WHO)では、高齢化や生活習慣に伴う重要な疾患(老化関連疾患)を「非感染性疾患(NCDs)」として位置付け、がん・糖尿病・呼吸器疾患・循環器疾患の4つの疾患が対象となっています。2023年の全世界の死亡者の74%がこれら疾患で亡くなっています。当社の開発品目は、これら4疾患を全て対象としております。
また、少子化問題も重要な社会的課題ですが、少子化問題に注力している製薬企業は多くはありません。当社は、女性に特有の疾患(月経前気分不快障害、更年期障害、乳がんAI診断)や小児の疾患(フェニルケトン尿症迅速診断など)の医療課題にも注力しています。
- 外部の研究機関や医療機関との連携を重視する理由は何ですか。
-
医療イノベーションの創出における大学などの公的研究機関や医療機関の役割が広がりつつあります。従来からの低分子合成医薬品と異なり、遺伝子工学等を利用したバイオ医薬品の技術基盤やシーズは大学などの公的研究機関にあります。また、人工知能(AI)を活用したプログラム医療機器の開発に必要な医療データは医療機関が有しています。
当社は、多くの医療機関の複数の診療科と医師主導治験を実施しているために、医療現場の医療課題を把握する機会が多く、またAI開発に必要な医療データも比較的短期間で取得しやすい環境にあります。当社は自社のリソースや研究環境にこだわるのではなく、むしろ外部リソースや外部環境を積極的に活用することにも注力し、効率的にイノベーションを創出する枠組みを構築したいと考えています。
- 基礎研究から医師主導治験まで一気通貫で開発する利点は何ですか。
-
当社は基礎研究から治療のコンセプトやアイデアを着想し、医薬品や医療機器などの「モノづくり」を行っています。適切な動物や細胞を用いた非臨床試験を終了し、必要なヒトにおける臨床試験(治験)で実証し、出来れば販売の許可を受けるための承認申請に近いところまで自社で対応したいと考えています。
例えば、2022年12月に承認を得た医療機器(極細内視鏡)は、製品開発から非臨床試験の実施、臨床試験(研究を実施している医師が自ら行う医師主導治験)の終了まで複数の大学と共同で開発を進め、国外医療機器企業に導出後に承認申請を行いました。また、血液がんの一種である慢性骨髄性白血病の治療薬は現在、承認申請に必要な最後の臨床試験である第Ⅲ相試験を実施中ですが、今後も希少疾患では第Ⅲ相試験まで自社で実施したいと考えています。その理由は、希少疾患などの治療薬は大手製薬企業からは注力されにくい場合があるからです。
自社で承認に近いところまで開発することで、確実に重要なシーズを社会実装することが可能です。また、開発ステージが後期の段階で導出することで、当社の受け取る対価も大きくなり、株主の皆様にも還元出来ると考えています。
- 基礎研究から医師主導治験まで一気通貫で開発できる理由は何ですか。
-
当社は、基礎研究から臨床試験まで広く研究を実施している医師(physician-scientistという)との共同研究を重視しています。基礎研究分野で共同研究を行っている多くの研究者は医師でもあり、自ら治験調整医師(治験責任者)として医師主導治験を実施することが可能です。基礎研究と臨床研究を実施する研究者が同じである場合が多いので、基礎研究から医師主導治験まで一気通貫で実施、効率的な開発ができます。
- オープンイノベーションの利点は何ですか。
-
これまでの製薬企業や創薬ベンチャーの多くはパイプラインのバリューチェーン(開発の全ての工程の積み上げ)を自社で全て構築し、事業価値を高めることに注力してきました。しかし、医薬品のように成功確率が極めて低く、開発期間が長く、投資が大きな分野では研究開発及び事業リスクが大きいため、多くのパイプラインを組み合わせたポートフォリオを形成し、リスク分散をすることが不可欠です。大手製薬企業は潤沢な資金を背景に、多くはパイプラインのバリューチェーンを自社独自で形成するという既存の枠組みでの開発ができますが、ベンチャーのように資金が潤沢でない場合は、なかなか難しいのが現状です。
当社は外部機関(研究機関、医療機関)のリソースを活用し、コストを含めた開発効率を高めた開発を実践してきました。外部機関とのアライアンスをもとに多くのバリューチェーン構築を考えており、既存ベンチャーとは戦略、研究開発、人的資源管理などが異なります。少ない人的リソースや経費で多くのパイプラインを広げ、モダリティを展開し、成果も出つつあります。
自己資源や社内環境のみにこだわるのではなく、むしろ外部資源や外部環境の積極的活用に注力し、効率的にイノベーションを創出する枠組みを構築していきたいと考えています。当社は、大学や様々な異業種企業との連携や協業を基にオープンイノベーションを推進し、効率的な開発を実施しています。
- 東北大学レナサイエンスオープンイノベーションラボ(TREx)と広島大学レナサイエンスオープンイノベーションラボ(HiREx)を設立した理由は何ですか。
-
当社は2022年1月、東北大学大学院医学系研究科メディシナルハブ(宮城県仙台市青葉区星陵町2-1 医学部5号館)に東北大学レナサイエンスオープンイノベーションラボ(Tohoku University x Renascience = TREx)を開設しました。
当社は創業当時、腎臓病の疾患動物モデル飼育施設を含む研究所を神奈川県・川崎バイオ特区に有しておりました。その後、研究対象が腎臓病から多くの疾患領域に拡大し、研究段階が基礎から治験へ進むにつれ、当初の腎臓病の疾患動物モデルを主体とした研究所は閉鎖しました。
しかし、多くの疾患領域に対する最先端の科学技術成果の活用の「場」、医師や研究者とのFace to Faceの交流の「場」、行政や医療産業企業とのオープンイノベーションの「場」が必要であると考え、TRExの開設に至りました。 TRExは2021年4月に締結された「仙台市と東北大学との地域経済発展に関する協定」に基づく拠点立地の第一号案件でもあります。TRExでは、1)東北大学大学院医学系研究科の研究者、東北大学病院の医師、メディシナルハブに参画する企業、行政など異業種との連携が加速され、2)既存の開発パイプラインの研究推進と複数の新規シーズの導入ができ、3)医師主導治験の実施、医療データの取得、公的資金獲得、許認可戦略の立案などを効率的、迅速に対応できており、4)人材の育成と確保にも繋げられています。当社の強みである研究開発の高い効率性をさらに加速することができています。
2023年4月に広島大学と包括的連携協定を締結し、TRExに続いて広島大学レナサイエンスオープンイノベーションラボ(Hiroshima University x Renascience = HiREx)を開設しました。HiRExを活用して、非小細胞肺がんや皮膚血管肉腫など医薬品の医師主導治験、糖尿病治療支援AIや維持血液透析医療支援AIなどのプログラム医療機器の臨床性能試験など複数の臨床試験を実施します。
- 公的研究費の獲得を重視する理由は何ですか。
-
医薬品の研究開発、特に治験の実施には多額の研究開発費が必要です。当社は、開発シーズを、医師主導治験を活用しながら開発し、製薬企業等へライセンスアウトするビジネスモデルを基本としておりますので、多大な研究開発費を自社で負担する必要があります。しかし、公的研究補助金(競争的資金)を積極的に活用することで、これらリスクの高い医師主導治験に要する研究開発費の自己負担を軽減しております。今後も引き続き公的研究補助金を積極的に獲得し活用したいと思います。
- 監査等委員会設置会社へ移行した成果はどうですか。
-
効率的かつ迅速な経営判断を行うため、さらに当社の企業規模を鑑み、最適なガバナンス体制を検討した結果、監査等委員会設置会社の導入が適切と判断し機関設計の変更を行いました。社外取締役からの客観的な意見を意思決定に反映させることができ、これまで以上に透明性の高い経営ができていると考えます。
学会発表・社外活動
- レナサイエンスは何か社会的な活動を行っているのですか。
-
少子化問題は重要な社会的課題です。当社は、女性(月経前気分不快障害、更年期障害、乳がんAI診断)や小児(フェニルケトン尿症迅速診断)の医療課題にも注力しています。そのため、小児や女性の社会的活動を支援することも当社の社会的責任(corporate social responsibility、CSR)と考えます。下記の具体例に加えて、今後も小児や女性の啓発活動を支援します。
- 最新の学会活動について教えてください。
-
□東北大学など複数の大学・医療機関と共同開発している維持血液透析医療プログラム医療機器に関する学会発表
・2023年10月22日 日本アフェレシス学会
第44回日本アフェレシス学会(会期:2023年10月20日~22日、会場:アイーナいわて県民情報交流センター)のシンポジウム「安全なアフェレシス療法を目指して」(10月22日開催)において、共同研究者である東北大学大学院医学系研究科准教授・宮崎真理子先生が発表を行いました。
・2023年9月17日 日本腎臓学会東部学術大会
第53回日本腎臓学会東部学術大会(会期:2023年9月16日~17日、会場:仙台国際センター)のシンポジウム「デジタルネフロロジー~医工連携、AIから生まれる未来の腎臓病診療~」(9月17日開催)において、東北大学大学院医学系研究科・宮田敏男教授(当社取締役会長)が発表を行いました。
□当社プラスミノーゲンアクチベーターインヒビター-1(PAI-1)阻害薬に関する発表
・2023年11月3日 第64回日本肺癌学会学術集会
当社は、広島大学と2022年10月31日に共同研究契約を締結し、また2023年4月24日に包括的研究協力に関する協定書を締結して、非小細胞肺がん治療薬としてのPAI-1阻害薬に関する共同研究を実施しています。2023年9月26日には複数の抗がん剤治療歴を有する切除不能な進行・再発の非小細胞肺がん患者を対象とした免疫チェックポイント阻害薬ニボルマブとRS5614との併用投与の有効性及び安全性を検討するための第Ⅱ相医師主導治験を開始しました。
このパイプラインに関連して、第64回日本肺癌学会学術集会(会期:2023年11月2日~11月4日、会場:幕張メッセ)において、共同研究者である広島大学病院呼吸器内科・益田 武 診療講師が、ワークショップ「創薬を目指したトランスレーショナルリサーチの最前線」において「非小細胞肺癌の進展に対する PAI-1 の関与の検討―PAI-1 阻害剤を用いた 医師主導治験への取りくみ―」(11月3日)を、また、広島大学病院呼吸器内科・隅井 允彦 先生が一般演題「薬剤耐性とその克服」において「非小細胞肺癌における免疫チェックポイント阻害剤に対する初期耐性の克服―PAI-1を標的とした治療法の開発―」(11月4日)を講演しました。
・2023年7月28日 Bio Asia-Taiwan Asian Biotechnology Conference 2023
2023年7月26日から30日まで台湾の台北において開催されたBio Asia-Taiwan Asian Biotechnology Conference 2023において、東北大学大学院医学系研究科 宮田敏男教授(当社取締役会長)が、PAI-1のがんや老化における新たな役割、またこれらの疾患治療薬としてのPAI-1阻害薬の研究開発について講演しました。なお、この内容は、Global Bio Investment環球生技月刊誌2023年8月25日号に、Bio Asiaでの日本からの革新的な医療イノベーション研究の1つとして掲載されました(Global Bio Investment誌への当社パイプラインに関する記事掲載のお知らせ | Renascience-レナサイエンス-)。
事業関連
- 医薬品開発の成功確率を高めるために何が重要ですか。
-
医薬品開発において重要なことは安全性と有効性の確認です。安全性は、一般毒性や遺伝毒性など薬事規制上で決められた試験に従い実施するので、時間と資金があれば対応可能です。一方、有効性の評価は単純ではなく、医薬品がどの疾患に有効かを見出すことは難しい課題です。
1つの医薬品の開発には多くの時間と費用がかかります。当初想定された疾患での有効性は得られなくても、別の疾患には有効である可能性はあるので、多くの疾患で医薬品の効能性を検討することが、成功確率を高める(失敗しない)上でも重要になります。この医薬品の適応疾患を広く検討すること(ドラッグリポジショニング)は難しく、全ての疾患で検討することは現実的に無理です。
当社は、国内外の公的研究機関に所属する研究者に当社開発の化合物を「オープンリソース」として提供しています。最先端の基礎研究を展開する様々な領域の研究者と共同で開発できる当社の枠組みは、自社の限られたリソースのみで基礎研究を行うより、遥かに効率的かつ広範囲にわたったドラッグリポジショニング研究が実施できます。
- 医師主導治験の利点は何ですか。
-
当社の臨床試験は、研究者でありかつ医師であるphysician scientistによる医師主導治験です。 医師主導治験の圧倒的な利点は、「質」と「スピード」、すなわち「効率」です。
医師主導治験では、最新の研究成果に触れることが可能な研究の最前線にいて、医療現場では患者を日々診療している医師が、適切な患者対象と試験計画を立案することができます。また、医師自ら治験を実施できるので、未承認薬の初期段階の治験(有用性や安全性を最初に確認する段階で、探索的臨床試験と言われる)には、適した治験の枠組みです。また、オーファン疾患(希少疾患のこと。患者数が少ないので売上も多くを望めない。)の治療薬開発は、収益性が低いために製薬企業が着手しないことから、最初から最後まで医師主導治験で行わざるを得ない場合もあります。研究開発費用のほぼ大半は、基礎研究段階では無く、臨床開発段階で費やされるものです。 医師主導治験は、最先端の大学等の科学技術成果を速やかに活用でき、治療の対象となる患者を治験実施医師が適切に選択できることから、開発コストを削減できます。
適切な治験調整医師を見出し、大学など複数の大きな医療機関の支援を得られた場合、企業治験に比べて医師主導治験は大きなアドバンテージがあり、短期間に大型の治験も実施できるために、当社は他社と異なりこの治験の形を優先しています。
- 医師主導治験は海外承認薬(国内未承認)や既存薬の適応拡大のための治験ではないのですか。
-
2003年の薬事法改正によって、医師自らが治験を実施する医師主導治験の道が開けました。しかし、治験に必要な医薬品を安全性試験、製剤を含めて全て自ら準備することは依然として難しい状況です。
法改正当時は、海外承認国内未承認の新薬や適応外使用薬(いわゆるドラッグラグ)も数多く存在したので、国内未承認薬や適応外使用薬の適応拡大が医師主導治験の対象の主流でした。治験の実施し易さ(製造から安全性試験など既存のデータで対応可能)という点からも、多くの大学を含む医療機関の医師が海外承認(国内未承認)の新薬や適応外使用薬の治験を医師主導で取り組みました。また、製薬企業が取り組まない希少疾患を対象に既存医薬品を用いて医師主導治験として実施される場合もありました。そのような背景から、「医師主導治験は海外承認薬(国内未承認)や既存薬の適応拡大が対象」という印象がいまだに強いのだと思います。
しかし、当社が行う治験は全て未承認の薬剤(first-in-human)を対象としており、海外承認薬(国内未承認)や既存薬の適応拡大のための治験ではありません。当社の医薬品は未承認の薬剤で知財も確保していますので、独占的な事業化が可能であり、充分な収益を得ることが可能です。
- 医師主導治験で承認申請は可能ですか。
-
当社の医薬品開発においては、非臨床試験はGLP(Good Laboratory Practice、医薬品の安全性の実施に関する基準)、治験薬の製造は治験薬GMP(Good Manufacturing Practice、治験薬の製造管理及び品質管理に関する基準)を遵守して実施しています。また、医師主導治験は、企業治験と同様にGCP(Good Clinical Practice、医薬品の臨床試験の実施に関する基準)を遵守して実施しています。そのため、承認申請や許認可を得る上で使用することができます。
- 医薬品のパイプライン数が多い理由は何ですか。
-
当社は、国内外の大学などの公的研究機関に所属する研究者に当社開発の化合物をオープンリソースとして提供し、医薬品の適応疾患の拡大可能性を広く検討すること(ドラッグリポジショニングという)を効率的に実施することで、数多くの医薬品のパイプラインを増やすことに成功しています。
臨床開発候補品でない化合物はサンプル提供契約(Material transfer agreement, MTAという)で提供し、臨床候補化合物は共同研究契約(研究の許諾実施、知的財産取り扱い、事業化後の対価還元などを包括する契約)の下で提供します。当社のプロジェクトに関して、オープンリソースとして MTA下で提供した化合物などを用いて研究を行った機関は、科学論文として公開されているものだけで、創業時以降100以上の研究機関に至ります。これら多くの国内外の共同研究から思いもよらなかったようなシーズ(コンセプト)が生まれています。
- どのような判断でパイプライン開発を決めていますか。
-
当社では、下記の表に記載する「科学性」「医学性」「経済性(事業性)」及び「時間軸」の4つを総合的に勘案し、パイプライン開発を決定しています。

- 知財に関して配慮している点は何ですか。
-
当社は、大学などの公的研究機関と共同研究を実施しているので、知財は基本的に大学等との共同出願(共願)となります。大学等の職務発明規定を遵守の上で、大学産学連携部門(知財部門)と協議を重ね、学内ルールに従った知財出願、管理、運用が求められます。また、発明者、出願人、権利の持分比率、費用負担、さらには実施権許諾の条件(範囲、対価)などを合意の下に知財を出願します。これら交渉と合意にはかなりの時間(数ヶ月)を要するために、それら期間を想定した知財出願計画を策定する必要があります。
当社の知財は、国内に加えて事業が想定される多くの国外も含めて対象国を決める必要があり、また物質特許に加えて用途特許、用法・用量特許など、関連する複数の知財を適切にかつ継続的に出願、維持管理、運用しています。
- 大学の研究者と多くの共同研究を実施できる理由は何ですか。
-
当社は、国内外の公的研究機関に所属する研究者に当社開発の化合物をオープンリソースとして提供しています。 公的研究機関に属する研究者の研究室には、専門領域の研究設備や独自の疾患動物モデルなどがありますが、医学や生物が専門の研究者であり、医薬品候補化合物は有していません。
当社の進めるオープンリソースの方針により、この化合物の情報を得た多くの国内外研究者からの依頼が増えています。特許出願の後には、共同研究者の先生に自由に学会や論文発表をしていただけますし、当社の化合物を基に科学研究費の申請を行っていただくことも承諾しています。 最先端の基礎研究を展開する研究者と共同で開発できる当社の枠組みは、自社の限られたリソースのみで基礎研究を行うより、遥かに効率的かつ広範囲にわたった研究が実施できます。
- 人工知能(AI)を活用したプログラム医療機器の研究開発における当社の利点は何ですか。
-
医療分野への人工知能(AI)の応用は大きな可能性を秘めたテーマですが、研究開発に重要な役割を担うステークホルダーが、個々に課題を抱えている状況です。
医師(医療機関)は、医療の課題や問題(ニーズ)を熟知し、豊富な医療データやアイデアなどを有してはいるものの、AIの手法やITベンダーとのネットワークが乏しく、研究開発に具体的に着手できない状況です。一方、AI技術を有するITベンダーは、成長が見込める医療分野への応用に興味はあるものの、医師(医療機関)とのネットワークが少ないために医療ニーズや医療データにアクセスしにくいこと、さらに薬機法など薬事行政の経験も不充分なために実用化は簡単ではありません。さらに、AIの医療応用を事業化したいと考える出口の製薬・ヘルステック企業も、研究から事業開発まで自社単独で全て対応することは時間的にもリソースの観点からも困難な場合も多いといえます。
そこで、課題を有する医師(医療機関)、AI技術を有するITベンダー、出口の製薬・ヘルステック企業が、当初から連携し開発を進める枠組みが重要になります。AIを活用したプログラム医療機器のプロダクトライフサイクルは医薬品ほど長くないため、効率的な研究開発には開発初期から許認可や実臨床への出口を見据えた計画が不可欠になります。そのためにも、異分野分業のオープンイノベーションが重要で、医師に加えて、データサイエンティスト、AI研究者、薬事専門家が連携して取り組む必要があります。
当社は、多くの医師主導治験の実施の過程で多数の医療機関や複数の診療科とのネットワークを構築しており、医療課題や医療データにアクセスしやすいこと(医療面でのサポート)、オープンイノベーションを通して複数のIT企業と共同研究事業契約を締結できていること(技術面でのサポート)、医薬品の医師主導治験を実施する過程で薬事規制にも対応できることなど利点を有しています。
- 人工知能(AI)を医療応用する上で重要なことは何ですか。
-
医療AIの研究開発に不可欠な要素は、1)医療課題、2)医療データ(質と量)、3)AIアルゴリズム(エンジン)です。優れた技術があっても、医療現場のニーズに合致せず、医療現場での使用に課題があるなどの理由から、実用化が難しい事例は多く、技術を有する多くの企業で直面する問題です。
近年、医療現場のニーズを出発点として問題の解決策を開発し、医療現場で最終プロダクトをイメージして最適化を行う「バイオデザイン」という手法が注目されています。AIをコア技術とするプログラム医療機器も同様で、AI技術は勿論重要ですが、医療データの対象は機械ではなく個人差のある患者です。医療課題、医療データ、医療現場での医師の助言に基づくAIのカスタマイズが極めて重要になります。
AI研究における必要不可欠なマテリアルは医療データです。AIは多数のデータから法則性を発見するため(帰納推論)、充分な量のデータが必要であることは間違いありませんが、データ量に加えてデータの質も重要です。 さらに、解決すべき医療課題と活用する医療データの種類に基づいて、最適なAIアルゴリズムを選定する必要があります。特定のAIアルゴリズムを活かせる医療分野を探すのでは無く、特定の医療課題を解決するために「最適なAIアルゴリズムを選定(場合によっては独自に開発)」する必要があります。また、AIアルゴリズムが決定できた後、データさえあればデータサイエンティストはAIで分析することができますが、その結果が正しいのかどうかを解釈、判断できるのは医師のみです。従って、医師の関与がない限り、質の良い医療データをAIに学習させ、課題を解決することは出来ません。
医師、データサイエンティスト、AI研究者の連携が重要で、医療課題、医療データ、経験・知見が存在する医療現場(医師)の積極的な関与がAIによる医療課題解決の成功の鍵となります。
人工知能の医療応用についての研究開発を推進するため、2022年11月にはNECソリューションイノベータ株式会社(NES)との基本合意書を、また2023年6月には日本電気株式会社(NEC)との共同研究契約書(基本合意書)を締結しました。
- 会社の規模に適したパイプライン数はどれほどですか。
-
当社は、国内外の大学などの公的研究機関に所属する研究者に当社開発の化合物をオープンリソースとして提供することで、自社の限られたリソースの中で医薬品の適応疾患の拡大可能性を広く検討すること(ドラッグリポジショニングという)を効率的に実施しています。自社リソースを特に必要としないので、非臨床試験(疾患動物モデルでの試験)のプロジェクト数に制約はありません。臨床開発は医師主導治験で実施し、医薬品開発業務受託機関 (Contract Research Organization、CRO)などを活用するため自社の人的リソースも少なくて済みます。
2022年度の治験実施数は7件、2023年度の治験実施数は9件、2024年度の治験実施予定数は10件(うち臨床性能試験2件)と徐々に増加しています。今後も継続的に少なくとも年間5件程度の治験を医師主導で実施することを目標として掲げています。人工知能(AI)を活用したプログラム医療機器に関しては、探索レベルでは、年間10件程度のシーズ開発が当社のリソースから適した数と判断しています。この中で約3割程度が実用化レベル(臨床性能試験など臨床試験を実施)に移行すると考えています。
- 現在、優先順位が高いパイプラインは何ですか。
-
臨床開発段階の進んだパイプライン開発の優先順位が高いです。
医薬品ではプラスミノーゲンアクチベーターインヒビター1(plasminogen activator inhibitor-1, PAI-1)阻害薬のがん領域及び呼吸器領域での開発に注力しています。がん領域では、慢性骨髄性白血病が第Ⅲ相試験実施中、悪性黒色腫は第Ⅱ相試験を終了、非小細胞肺がん、皮膚血管肉腫が第Ⅱ相試験を開始しました。呼吸器領域では、新型コロナウイルス肺傷害が第Ⅱ相試験終了、全身性強皮症に伴う間質性肺疾患の第Ⅱ相試験を開始しました。
医療機器(極細内視鏡)の研究開発はほぼ終了しており、メイン部分のファイバースコープに関しては2022年12月に承認が降り、付属部分のガイドカテーテルの開発はほぼ完了したので、今後承認準備を進める予定です。
人工知能(AI)を活用したプログラム医療機器に関しては、糖尿病治療支援AIや維持血液透析医療支援AIなどのプログラム医療機器の開発が先行しており、今後承認申請のための臨床性能試験を実施する予定です。
- PAI-1阻害薬を呼吸器疾患で開発する理由は何ですか。
-
PAI-1は血栓の溶解に必要なタンパク質ですが、炎症や組織の線維化にも深く関与しています。この作用に基づき、呼吸器疾患を対象とした開発を進めています。具体的には、新型コロナウイルス肺傷害(第Ⅱ相試験終了)、全身性強皮症に伴う間質性肺疾患(第Ⅱ相試験)、間質性肺炎(非臨床試験)などのプロジェクトが進行中です。
- PAI-1阻害薬をがん領域で開発する理由は何ですか。
-
PAI-1の発現が高いがんは悪性度が高く、予後不良であることがわかっています(’PAI-1パラドックス’)。当社は、PAI-1ががん細胞の免疫チェックポイント分子(PD-L1など)の発現を促進することを共同研究で見出しました。当社のPAI-1阻害薬の投与でがん細胞の免疫チェックポイント分子の発現が低下し、腫瘍内の細胞障害性T細胞の浸潤が増加し、腫瘍関連マクロファージを抑制することも大腸がんや悪性黒色腫マウスモデルで明らかになりました。
これら非臨床試験の成績に基づき、悪性黒色腫の第Ⅱ相試験を実施し、想定通りの有効性を確認することができました。すなわち、ニボルマブ不応答の悪性黒色腫患者に、ニボルマブとRS5614を8週間併用したところ奏効率24.1%(7/29例)が得られ、この成績は既存のニボルマブとイピリムマブ併用の奏効率を上まわる結果でした(本邦におけるニボルマブとイピリムマブ併用の奏効率は13.5%)。また、このコンセプトに基づいて、非小細胞肺がんを対象とした第Ⅱ相医師主導治験を実施します。PAI-1パラドックスが実際にがん治療でも関与しており、一部のがん種ではPAI-1阻害薬の併用が有効であることを確認します。
- PAI-1阻害薬はどのように取得されたのですか。
-
ヒトのPAI-1分子の結晶構造を基に、コンピューター工学を利用した約200万バーチャル化合物ライブラリーの探索から96個のPAI-1阻害候補化合物を取得しました。PAI-1活性阻害作用を指標として、新規阻害化合物を10年以上かけてこれまで1,400個以上合成し、薬効をスクリーニングした上で、さらにそれらの有効性や安全性などを評価する中で、安全性に優れた経口投与可能なリード化合物であるRS5275を取得しました。RS5275からさらに合成展開を行い、4つの臨床候補化合物RS5441、RS5484、RS5509、RS5614を取得しました。その中で最終的にRS5614を臨床開発候補化合物として選択しました。
- PAI-1阻害薬開発の国内外の競合状況はどうですか。
-
過去に国内外大手を含む多くの製薬会社やバイオベンチャーが低分子PAI-1阻害薬の開発に取り組みました。幾つかの薬剤はマウスやラットの動物モデルで有効性が報告され、PAI-749(Diaplasinin)は臨床ステージまで進みましたが、ヒトでの効果は見られず、臨床第Ⅰ相試験で開発は中止されました。
- PAI-1阻害薬の安全性に問題は無いですか。
-
非臨床試験では、安全性薬理試験(hERG試験、ラットの中枢神経系、サルの心血管系及び呼吸器系試験)、一般毒性試験(ラットの26週間の経口投与試験、サルの39週間経口投与試験)、遺伝毒性試験、光毒性試験、生殖・発生毒性試験を実施して、臨床試験や承認申請をする上で問題ないことを確認しています。
第Ⅰ相単回投与試験では、RS5614の240mgまでの安全性が確認され、第Ⅰ相反復投与試験においては120mgを7日間経口投与した際に発現した有害事象はいずれも軽度でした。RS5614は、これまでに200名を超える被験者(健康人、慢性骨髄性白血病、新型コロナウイルス肺傷害、悪性黒色腫など)に投与され、慢性骨髄性白血病では1日180mg、48週間の投与(33例)が実施されましたが、治験薬が関連する問題となる重篤な有害事象は報告されておらず、安全性の高い医薬品と考えられます。
- PAI-1阻害薬を慢性骨髄性白血病(CML)で開発する理由は何ですか。
-
血液がんの一種である慢性骨髄性白血病(CML)は、造血幹細胞の染色体に異常が起こり、がん化した白血病細胞(CML細胞)が無制限に増殖することで発症します。
CMLに対する治療薬はチロシンキナーゼ阻害薬TKI(イマチニブなど)が主流ですが、TKIは、CML細胞には作用しますが、骨髄のニッチと呼ばれるところに潜み、CMLの元となるCML幹細胞には作用しないことから、TKIを休薬するとCML細胞が増殖し、CMLの根治には至りません。 PAI-1阻害薬はCML幹細胞に作用して、TKIの作用を増強させることで、CMLの根治をもたらすことが明らかとなりました。実際に、CMLモデルマウスにRS5614とTKIを併用すると、TKI単独投与に比べて骨髄に残るCML幹細胞数が著明に減少し、生存率が大きく向上しました。
TKIの開発によりCML患者の予後は大きく改善しましたが、CMLを治癒するためには長期にわたる高額なTKI治療の継続が必要です。長期継続服用による副作用も問題となっています。そこで、可能な限り早期にTKI服用を必要としない治癒(Treatment free remission、TFR)に導くことが重要です。 RS5614は、早期に多くのCML患者をTFRに導く新たな作用機序の安全な医薬品と期待されます。
- 慢性骨髄性白血病(CML)の第Ⅱ相試験の結果はどうでしたか。
-
前期第Ⅱ相試験では、TKI治療を2年間以上実施しているCML患者を対象に、RS5614 120mg/日、4週間併用投与(TKIは12週間継続)することにより、12週間後のDMR(Deep molecular response:最も高い治療効果)達成率を指標とする医師主導治験を東北大学、秋田大学、東海大学において実施しました。21例が組み入れられ、脱落や中止例はなく、全例が解析対象例となりました。主要評価項目の結果は、21例中DMRを達成した症例は4例で、12週時の累積DMR達成率は20.0%でした(これまでのTKI単独投与による3か月時点での平均的累積DMR達成率は2.0%(TKIだけでの治療を受けた場合を、ヒストリカルコントロールという))。安全性評価では、解析対象例の全21例に副作用は認められませんでした。
後期第Ⅱ相試験では、CML患者を対象にTKIとRS5614(150mg/日より開始し、180㎎/日に増量可)を併用し、RS5614投与開始後48週のDMRの累積達成率をヒストリカルコントロール8.0%と比較して33.0%が期待できることを確認することと、RS5614及びTKIの長期併用時におけるRS5614の薬物動態及び安全性の確認を目的に実施しました。33例中DMRを達成した症例は11例で、48週時の累積DMR達成率は33.3%でした(期待と同等以上の結果(POC)でした)。安全性は、治験薬との因果関係で重篤な有害事象はありませんでした。
- 慢性骨髄性白血病(CML)の第Ⅲ相試験に関して教えてください。
-
後期第Ⅱ相試験の成績に基づいて、東北大学、東海大学、秋田大学など12の大学等の医療機関と共同で慢性期CML 患者を対象にTKIとRS5614の併用効果を検証するプラセボ対照二重盲検の第Ⅲ相医師主導治験を実施中です。本試験は国立研究開発法人日本医療研究開発機構(AMED)の令和4年度「革新的がん医療実用化研究事業(東北大学が研究代表機関であり、当社も分担研究機関として参画)」に採択されました。
独立行政法人医薬品 医療機器総合機構(PMDA)と2021年11月及び同年12月に対面助言を行い、2022年5月にPMDAに治験計画届を提出し、多施設共同の第Ⅲ相試験を開始しました。TKI治療期間が3年以上の慢性期CML患者60名を対象とし、TKI単独投与群よりも治験薬RS5614の併用群が2年間以上のDMR維持率を有意に上昇させることを検証します。
- PAI-1阻害薬を悪性黒色腫(メラノーマ)で開発する理由は何ですか。
-
現在、がんの治療には、①手術療法、➁放射線療法、➂化学療法(抗がん剤)、④免疫療法があり、4大治療法と呼ばれています。このうち免疫療法は体に備わっている免疫本来の力を利用してがんを攻撃する治療法です。様々な免疫療法が提案されましたが、効果が証明された免疫療法の中でも免疫のブレーキを阻害する免疫チェックポイント阻害薬が主なものです。過剰な免疫反応は有害ですので、体内にはそれを抑える機構が備わっています。そのようなブレーキ機能を担う分子は免疫チェックポイント分子と呼ばれています。実は、がんはこの免疫チェックポイント分子を悪用することで自分自身に対する免疫が働かないようにしています。
免疫チェックポイント阻害薬は、免疫チェックポイント分子を阻害することで、このブレーキを解除し、がんに対する免疫応答を活性化します。当社は、PAI-1が免疫チェックポイント分子を介してがん免疫を阻害することを見出しました。動物モデルでの試験で、RS5614を投与した動物で悪性黒色腫(メラノーマ)や大腸がんなどのがんが退縮すること、さらに免疫チェックポイント阻害抗体と併用することで相乗的に強くがん免疫が増強されることが分かりました。
PAI-1阻害薬RS5614が有する免疫チェックポイント阻害作用は悪性黒色腫(メラノーマ)の第Ⅱ相試験で確認されました。
(悪性黒色腫とは)
悪性黒色腫は皮膚がんの一種で、皮膚の色と関係するメラニン色素を産生するメラノサイトという皮膚の細胞が悪性化してできる腫瘍です。皮膚がんの中でも転移率が高くきわめて悪性度が高いとされています。悪性黒色腫患者は本邦では10万人に0.6人と少ないですが、米国では12.7人、オーストラリアでは33.6人と日本人の数十倍です。悪性黒色腫は極めて悪性度の高いがんです(5年生存率は、がんの大きさが4 mmを超えると50%程度、所属リンパ節転移がある場合は40%程度、遠隔転移がある場合は数%)。さらに、本邦における悪性黒色腫の進行の程度は米国と比べて3倍程度高いことが報告されています。これは、本邦の悪性黒色腫は、肢端黒子型というタイプの悪性黒色腫が多く、欧米とは異なっているために治療薬が奏効しづらいと考えられます。
悪性黒色腫の治療は、まず外科的に手術で切除されます。ただし、発見時既にがんが進行している場合も多く、根治切除不能の症例には、薬物療法(医薬品)が必要になります。悪性黒色腫には放射線療法はあまり有効ではありません。ニボルマブなど免疫チェックポイント分子を標的とする抗体医薬(免疫チェックポイント阻害薬)の登場により、薬物療法は画期的に進歩しました。ただし、本邦における悪性黒色腫に対するニボルマブの奏効率は22.2 %です。さらに、ニボルマブが無効な患者に対して、ニボルマブとイピリムマブとの併用療法が認められていますが、その奏効率は海外21%、国内13.5%です。なお、ニボルマブ・イピリムマブ併用療法は、半数を超える患者に重篤な副作用が出現し、単剤投与に比べて投与中止となる重度の免疫関連副作用の発現頻度は4倍と高く、数か月に及ぶ入院やがんに対する治療の中断が必要となることが問題となっています。また、高額医療費の課題もあり、抗体とモダリティが異なる経口投与可能で、副作用が少なく、奏効率を上昇させる併用薬が待ち望まれています。
(第Ⅱ相試験におけるRS5614の成績)
外科的に根治切除が難しい悪性黒色腫を対象に、PAI-1阻害薬RS5614と免疫チェックポイント阻害薬ニボルマブとの併用の有効性及び安全性を検討する第Ⅱ相医師主導治験を、東北大学病院など6医療機関と共同で実施した結果、ニボルマブとRS5614の併用は、既存治療であるニボルマブとイピリムマブ併用での報告より、同等以上の有効性を示しました(ニボルマブ+RS5614の奏効率24.1%、ニボルマブ+イピリムマブの奏効率13.5%)。また、ニボルマブとイピリムマブ併用は重篤な免疫関連副作用などによりその安全性が懸念されていますが、ニボルマブとRS5614の併用では問題となる副作用は認められませんでした。2024年2月に治験総括報告書を取りまとめられました。承認申請に向けて次相試験の準備を進める予定です。
- RS5614は悪性黒色腫の治療をどのように変えるのですか。
-
現在、悪性黒色腫においては、ニボルマブ無効例に対してイピリムマブとの併用の保険適応が認められておりますが、ニボルマブ・イピリムマブ併用での重篤な副作用が問題になっています。日本臨床腫瘍研究グループ(JCOG)は、非小細胞肺がんを対象としたニボルマブ+イピリムマブ併用療法の有効性を比較する第Ⅲ相試験(JCOG2007試験)を全国59施設で2021年4月より実施していましたが、ニボルマブ・イピリムマブ併用群で予想を超える約7.4%(148人のうち11人)の治療関連死亡が認められたため、2023年3月30日に本試験を中止しました。そのように、ニボルマブ・イピリムマブ併用は、がんの種類を問わず、問題となっています。
悪性黒色腫を対象とした第Ⅱ相試験において、ニボルマブ無効例に対して、RS5614・ニボルマブ併用は、ニボルマブ・イピリムマブ併用と同等かそれ以上の有効性を示し、ニボルマブ・RS5614併用はニボルマブ・イピリムマブ併用より高い安全性を示しました。以上から、免疫チェックポイント阻害薬単剤療法が無効の根治切除不能悪性黒色腫に対する新しい治療法開発は喫緊の課題であり、ニボルマブとRS5614の併用は、有効性も安全性も高い薬物療法となることが期待されます。
- RS5614は他の固形がん治療でも有用ですか。
-
動物モデルを用いた非臨床試験で、PAI-1阻害薬RS5614の経口投与で悪性黒色腫に加えて、大腸がん、肺がんなどのがんが退縮すること、さらに免疫チェックポイント阻害抗体との併用でこの作用は著しく増強されることが分かっています。そこで、非小細胞肺がんに対する第Ⅱ相医師主導治験と皮膚血管肉腫に対する第Ⅱ相医師主導治験を、広島大学病院など医療機関と共同で開始しました。
- 今回の悪性黒色腫第Ⅱ相試験結果の医学的意義は何ですか。
-
以前より、PAI-1の発現が高いがんは悪性度が高く、予後不良であることが多くのがんで報告されており、「PAI-1パラドックス」と言われてきました。当社は、国内外の多くの大学との共同研究から、がん細胞がPAI-1を産生し、PD-L1などの免疫チェックポイント分子の発現を増強することで、がん細胞が免疫系からの攻撃を回避している知見を見出し、動物モデルを用いた非臨床試験で、PAI-1阻害薬RS5614の経口投与で悪性黒色腫、大腸がん、肺がんなどを退縮させることを証明してきました。今回の治験で、外科的に根治切除が難しく、またニボルマブが無効な悪性黒色腫患者29例に対して、RS5614を8週間併用することにより、7例において奏効を確認することができました。既に、血液がんである慢性骨髄性白血病の薬物療法としてもRS5614が有効であることを第Ⅱ相試験(前期、後期)で実証しており、現在第Ⅲ相試験を実施中です。以上、「PAI-1パラドックス」が実際にがん治療でも重要であり、一部のがん種ではPAI-1が治療の標的でなること、さらにPAI-1阻害薬が薬物療法として有効であることをヒトで確認できました。
- 悪性黒色腫の第Ⅲ相試験に関して教えてください。
-
第Ⅱ相試験の成績(令和6年2月22日最終結果報告)に基づいて、東北大学など大学等の医療機関と共同で、免疫チェックポイント阻害薬のニボルマブが無効な外科的に根治切除が難しい悪性黒色腫患者を対象に、RS5614とニボルマブとの併用効果を検証するプラセボ対照二重盲検の第Ⅲ相試験(将来の薬事承認に必要な検証試験)を令和6年度中に開始する予定で準備を進めています。
第Ⅲ相試験の臨床プロトコールは、令和5年12月に実施したPMDA対面助言により既に確定しています。また、令和6年8月28日には本医薬品の本適応に関して、厚生労働省から希少疾患用医薬品指定も受けましたので、今後、国立研究開発法人医薬基盤・健康・栄養研究所の助成金申請なども考慮しています。
- RS5614は悪性黒色腫治療薬としていつごろ医療現場で使えるようになるのですか。
-
今回の試験で有効性を確認することができましたので、今後、規制当局との協議を行い、次相の臨床試験や承認申請など今後のロードマップを明らかにしてまいります。また、当社は医薬品製造販売業許可を持っていませんので、他の企業との協業により商業化の道筋も明確にしたいと考えています。
- PAI-1阻害薬RS5614は他の免疫チェックポイント阻害薬とどこが違うのですか。
-
これまでの免疫チェックポイント阻害薬はすべて抗体医薬で入院して注射で投与する必要のある医薬品で高額です。また、既存の抗体医薬は様々な副作用があることも分かっています。 RS5614は、安全性が高く、ご自宅で服用していただける飲み薬になると考えます。また、抗体と違って化学合成で製造されますのでその価格は抗体よりも低くなると考えられます。
- PAI-1阻害薬を肺がんで開発する理由は何ですか。
-
非小細胞肺がんに対する標準治療はプラチナ製剤併用化学療法と抗PD-1/PD-L1抗体を用いた免疫療法ですが、治癒に至る症例は少ないです。無効の場合には、2次治療としてドセタキセル等の化学療法が実施されますが、生存期間は3か月と短く、3次治療が必要となり、有効な3次治療は少なく新たな治療薬が待ち望まれています。当社は、PAI-1が肺がんの進展や増殖に関与していることを共同研究で見出し、抗PD-1抗体に耐性となったがん細胞はPAI-1の発現が極めて高いことを確認しました。実際に、肺がんモデルマウスを用いた非臨床試験で抗PD-1抗体とPAI-1阻害薬の併用投与が抗PD-1抗体単剤投与よりも高い抗がん作用を示すことを確認しました。これらの知見から非小細胞肺がんに対するPAI-1阻害薬RS5614の有効性と安全性を確認する第Ⅱ相試験を広島大学病院などで実施しています。
- PAI-1阻害薬を皮膚血管肉腫で開発する理由は何ですか。
-
皮膚血管肉腫は稀な軟部腫瘍(日本における年間発症数は300名程度)で、アポトーシス*誘導剤のタキサン系抗がん剤が第1選択薬となっています。しかし、タキサン系抗がん剤を使用した90例の皮膚血管肉腫の予後を検討した結果、全生存率は649日と治療効果は限定的であり、新たな治療薬の研究開発が急務となっています。PAI-1は主として血管内皮で産生されます。当社は、皮膚血管肉腫の検体解析で、PAI-1高発現が疾患の予後と強く相関している知見を見いだしました。PAI-1を高発現するがん細胞ではアポトーシス耐性になっている知見からも、PAI-1阻害薬を併用することで、タキサン系抗がん剤の血管肉腫治療効果を増強できる可能性が強く示唆されます。そこで、タキサン系抗がん剤パクリタキセルが無効となった皮膚血管肉腫患者を対象に、PAI-1阻害薬RS5614の有効性を確認する第Ⅱ相試験(医師主導治験)を東北大学などで実施しています。
*アポトーシス:細胞が傷ついて死亡するネクローシス(あるいは壊死)とは違って、細胞自身が持つ死のプログラムが活性化されて細胞死に至る現象
- PAI-1阻害薬を全身性強皮症で開発する理由は何ですか。
-
全身性強皮症(Systemin sclerosis、SSc)(指定難病51)は皮膚と多くの臓器の血管障害と線維化を特徴とする全身性の自己免疫疾患ですが、その病因は未だ不明です。皮膚の硬化や肺の線維化(Interstitial lung disease, ILD)、胃食道逆流症、心病変、手指潰瘍などの症状が生じる難病です。日本におけるSSc患者は、30,000人以上と推定されています。
ILDは、SSc患者の死因の3割超を占める重篤な障害です。ILDが直接の死因とならない場合にも、線維化によって肺の機能が損なわれるため、重度の咳や呼吸困難などが生じ、日常生活は著しく制限されます。現行の治療薬の効果は充分では無く、自己免疫疾患の治療が進んだ現在においては、自己免疫疾患の一種である関節リウマチや全身性エリテマトーデスでは疾患関連死は全死因の10%未満ですが、SScでは死因の70%を疾患関連死が占めており、有効な治療法の開発が強く望まれています。
当社が開発中のRS5614は、炎症、線維化、血管障害を抑制します。SScの病態は自己免疫に伴う炎症、線維化、血管障害が主体ですから、RS5614がSScの症状の進行を抑制する可能性が示唆されます。実際に、SSc動物モデルでRS5614の肺の線維化を、既存薬よりも抑制する効果が実証されました。
現行のSSc治療薬はステロイドや免疫抑制薬など副作用が強い薬剤が多いですが、RS5614は安全性が高いことからも、SScに伴うILDの治療薬としての有用性が期待できます。 そこで、SSc- ILDに対するPAI-1阻害薬RS5614の有効性と安全性を検討する第II相試験を、東北大学病院など国内の医療機関で実施しています(国立研究開発法人日本医療研究開発機構AMEDの委託)。
- PAI-1阻害薬を新型コロナウイルス肺傷害で開発する理由は何ですか。
-
新型コロナウイルス感染症(COVID-19)の世界的な蔓延は、社会的にも重要な課題です。感染者の約80%は軽症で経過しますが、特に高齢者や基礎疾患を持つ患者などでは重症化し、重症の肺炎や急性呼吸窮迫症候群(ARDS)に至ります。また、軽症例では自宅療養や宿泊療養の措置がとられていますが、発病当初は軽症であっても一部、急速に重症化する患者の存在が問題になっています。ワクチン接種やウイルス株の変異(オミクロン株)により、以前より重症化しにくくなっていますが、さらなる変異株により重症化する可能性等、今後の状況を注視する必要があります。また、COVID-19の感染症法上の分類が「2類」から「5類」に引き下げられたことに伴い、ご自宅あるいは外来で治療を受ける患者が更に増加すると考えられます。肺炎を惹起する新たな株の発生に際して、速やかに次相臨床試験を実施できるよう準備をしています。
当社は、肺炎の重症化を防ぐ治療薬、特に外来での処方も可能で自宅でも服用できる安全性と利便性の高い予防・治療薬(経口薬)を開発し、患者の延命のみならず、医療現場の負担軽減、医療資源の有効活用に寄与したいと考えています。新型コロナウイルスによる重症肺炎患者では、炎症、線維化など病変が急速に進行し、凝固系亢進の特徴的な所見が認められます。新型コロナウイルス肺傷害に極めて特徴的な所見は、肺内のフィブリン微小血栓、炎症、線維化です。当社が開発中のRS5614は、炎症、線維化、血管障害を抑制しますので、新型コロナウイルス肺傷害での有効性が考えられます。
- 新型コロナウイルス肺傷害の第Ⅱ相試験の結果はどうでしたか。
-
2020年秋から前期第Ⅱ相医師主導治験(非盲検)を実施し、2021年6月に治験総括報告書が完成しました。特筆すべき副作用は無く、肺傷害で入院し本治験薬を投与された26名全員が無事退院されました。
前期第Ⅱ相医師主導治験の成績に基づき、東北大学、京都大学、東京医科歯科大学、東海大学等国内20の大学等の医療機関と共同で、新型コロナウイルス肺傷害患者(中等症、入院患者)を対象とするプラセボ対照の後期第Ⅱ相医師主導治験を実施しました。本試験は、2021年3月にAMEDの「新興・再興感染症に対する革新的医薬品等開発推進事業(研究代表機関は東北大学、当社は分担研究機関)」に採択され、2021年4月のPMDA事前面談に基づき 実施計画書を確定して2021年6月から開始しました。感染者数が激減した時期やオミクロン株の出現により対象となる新型コロナウイルス肺傷害患者(中等症、入院患者)が減少したために、2022年10月末まで治験を延長し(登録症例数75例)、2023年4月に治験総括報告書が完成しました。
有効性の主要評価項目は、両群間で統計学的な有意差は認めませんでしたが、プラセボ群に対してRS5614群で悪化の抑制が見られ、特に比較的軽症の患者での有効性が示唆されました。さらに、酸素治療が必要となる症例の割合も、入院後3~5日でRS5614群の方が少ないことから、早期治療でのRS5614の有効性が示唆されました。また、RS5614群では、プラセボ群と異なり、肺炎画像所見の改善も認めました。副作用発現率はRS5614群とプラセボ群で同程度であり、COVID-19に伴う肺傷害患者に対する本被験薬(RS5614)投与の安全性も確認できました。
2020年12月25日、新型コロナウイルス肺傷害及びその他肺傷害等の肺疾患治療用途について第一三共株式会社とオプション権付優先交渉権に関する契約を締結しました。2022年11月には、新型コロナウイルス肺傷害だけではなく、抗がん剤治療等から生じる間質性肺炎に対するRS5614の有効性を確認する臨床試験も視野に入れ、オプション期間を2025年3月まで延長する覚書を締結しました。
- PAI-1阻害薬は新型コロナウイルス肺傷害以外の肺傷害にも有効ですか。
-
当社の開発したRS5614は、非臨床試験から血栓、炎症、線維化を抑制する作用が明らかになっており、間質性肺炎に有効である可能性が示唆されます。肺傷害の原因はウイルスのみならず、抗がん剤、自己免疫疾患、原因不明(特発性)など様々な原因がありますので、当社は新型コロナウイルス肺傷害に加えて、他の原因で生じる肺傷害に対する有効性に関しても臨床試験で検討する予定です。
その取組みの一環として、京都大学医学部附属病院呼吸器内科と特発性間質性肺炎の急性増悪を対象とする臨床試験の実施を視野に入れた共同研究を開始しています。特発性間質性肺炎の急性増悪は、特発性間質性肺炎患者死亡原因の約 40%を占める予後不良の病態です。また、抗がん剤治療などから生じる間質性肺炎に対する本医薬品の有効性を確認する臨床試験も視野に入れ、第一三共株式会社との契約も延長しました。さらに、全身性強皮症に伴う間質性肺炎に対するPAI-1阻害薬RS5614の有効性と安全性を検討する第II相試験を、東北大学病院など国内の医療機関で実施しています(国立研究開発法人日本医療研究開発機構AMEDの委託)。
- PAI-1阻害薬は老化防止に有効ですか。
-
当社は米国ノースウェスタン大学と共同で「PAI-1と老化」に関して研究をしてきました。
生物の細胞は細胞老化と呼ばれる現象のために、無制限に増殖することはできません。この現象には、遺伝子のテロメア長の短縮、更にはp53などの細胞老化因子が関与しています。老化した細胞は、p53に加えて、PAI-1の発現が極めて高いことが分かっています。実際に、p53やPAI-1を抑制することで細胞老化の現象は阻害できることが明らかになりました。細胞のみならず、老化した組織や個体(klothoマウス、早老症として有名なウェルナー症候群のヒト)でも、PAI-1の発現が高いことが報告されました。老化モデルとして有名なklothoマウスでは、PAI-1の発現や活性を遺伝子あるいはタンパクレベルで阻害することにより、老化の主症状を全て改善できることを明らかにしました。
さらに、米中西部に暮らすキリスト教の一派、アーミッシュコミュニティーの人々を調査し、PAI-1遺伝子を持たない人は、持っている人に比べて10年長生きすることを見出しました。また、欠損する人々は糖尿病など病気にもかかりにくいことも分かりました。
これらの事実は、2017年11月にニューヨーク・タイムズ始め、多くの新聞で報道されました。研究代表者のノースウエスタン大学の主任教授は「彼らはより長く生きているだけではない。より健康的に生きている。長生きの理想型だ。」と述べました。このヒトでの疫学調査は、細胞やマウスでの実験結果と一致しています。加齢と共に、がん、血管(動脈硬化)、肺(肺気腫、慢性閉塞性肺疾患)、代謝(糖尿病、肥満)、腎臓(慢性腎臓病)、骨・関節(骨粗鬆症、変形性関節症)、脳(脳血管障害、アルツハイマー病・認知症)などの疾患が発症します。興味深いことに、これら疾患の組織では、PAI-1の発現は極めて高くなっています。しかも、これらの疾患の動物モデルにPAI-1阻害薬を投与することで、その病態は著明に改善されることが確認されました。
近年、老化した細胞が免疫のブレーキになるタンパク(免疫チェックポイント分子)を発現し、免疫からの攻撃を逃れていることが示されました。免疫チェックポイント分子を阻害する薬剤(免疫チェックポイント阻害薬)を加齢マウスや生活習慣病マウスに投与すると、免疫が活性化されて老化した細胞が除去され、臓器や組織の老化現象や生活習慣病が改善しました。当社は、PAI-1ががん細胞の免疫チェックポイント分子の発現に関与し、がん細胞の増殖を促進すること、そしてPAI-1阻害薬が免疫チェックポイント阻害作用を有することを見出しました。このように、PAI-1はがんと老化を促進し、当社のPAI-1阻害薬はがんとその他の老化関連疾患に有効であると期待されます。
以上、PAI-1と老化に関しては興味深い知見が明らかになりつつあります。しかし、現時点では証明するための臨床試験を実施できないため、PAI-1阻害薬が老化防止に有効であるかは不明です。
- 月経前症候群(PMS)及び月経前不快気分障害(PMDD)の治験の状況はいかがでしょうか。
-
PMS/PMDDに対するRS8001の第Ⅱ相医師主導治験を、近畿大学、東北大学、東京医科歯科大学、東京女子医科大学と共同で進めています(プラセボリードイン方式*プラセボ対照二重盲検3群比較試験、目標症例数105例)。本治験は、2019年度にAMEDの「医療研究開発革新基盤創生事業(CiCLE)(当社が研究代表機関)」に採択されました。
当初予定の2021年2月より早い2020年11月から治験を開始しましたが、新型コロナウイルス感染の拡大の影響により患者来院数が減少したため、症例登録促進を目的として、2021年度に新たに2施設を追加したほか、院内ポスターや啓発用の冊子の作成、治験調整医師による薬剤師対象Webセミナーを実施しました。治験実施施設を2022年11月に3施設追加するとともに、ボランティアパネルの活用、治験責任医師等による公開講座の開催等を行った結果、目標登録症例数を達成しました。また、これまでのAMEDでの中間評価で継続判断がなされています。2024年6月に報告書が纏められました。今後の開発方針についてはAMEDと協議しております。
*プラセボリードイン方式:プラセボには有効成分は含まれていませんが、心理的な効果で病気の症状が改善することがあります(プラセボ効果)。そこで、実薬投与の前に一定期間プラセボを服用していただき、プラセボ効果の大きい被験者は試験に参加していただかない試験デザインを採用しています。
- 糖尿病治療支援AIプログラム医療機器とは何ですか。
-
糖尿病の血糖値を厳格にコントロールし、糖尿病合併症を予防するためにはインスリン注射治療が必要です。しかし、インスリンの安全な用量域は狭く、過剰投与で低血糖を生じるために、患者ごとに最適な種類と投与量を選定する必要があります。一方、糖尿病専門医は医師全体の2%もおらず、地理的にも偏在しているため、現状では糖尿病患者の主治医が糖尿病専門医であるとは限らず、むしろ非専門医に受診することが多いです。
そこで、非専門医にも専門医レベルのインスリン治療を実行できるよう支援するAI DM-SAiL(SAiLはSkill Acquisition Learning、スキル獲得学習AIアルゴリズムの略)を、東北大学及び日本電気株式会社(NEC)と共同で開発しています。東北大学病院に入院する約 1,000名(約1,080,000臨床パラメータ)の患者データに基づく分析作業が終了し、専門医の処方するインスリンの投与量から2単位程度の誤差で予測するAIを開発出来ています。 東北大学病院患者での正解率は、超即効型インスリン、持効型インスリンとも、正解率約90%、糖尿病専門医の処方からの誤差0.65~0.95単位と極めて高い結果が得られています。現在、NECソリューションイノベータ株式会社(NES)と本プログラム医療機器をクラウド上で使用するためのシステム開発を進めており、デモシステムの開発を完了しました。
2022年4月にAMEDの「医工連携イノベーション推進事業(開発・事業化事業)(当社が研究代表機関)」に採択されました。2022年12月にはPMDA開発前相談を終了し、2023年5月にはPMDAプロトコール相談(事前相談)を実施、実用化に向けての開発を進め、2024年8月より臨床性能試験を開始しております。
- 維持血液透析医療支援AIプログラム医療機器とは何ですか。
-
慢性腎不全患者は、廃絶した腎臓の代わりに除水と老廃物の除去を行うために週3回、生涯にわたって血液透析を受けます。除水不足は心不全、高血圧等心肺機能に障害を与える一方、過度な除水は透析中の低血圧を生じ、気分不良、意識消失といった有害事象をもたらします。不適切な除水量の設定により除水不足や過除水が生じ有害事象が発生すると医療従事者は患者対応に追われ、大きな負担となります。
安全安心な血液透析を実現するために、適切な目標総除水量を予測するAI(Dual-Channel Combiner Network、DCCN)を、東北大学及び日本電気株式会社(NEC)と共同で開発しています。聖路加国際病院や民間透析医療施設から取得した透析回数72.5万件の透析記録(患者情報、透析情報、検査情報)を学習させ、患者の過去5回の透析記録及び透析当日の透析前 データから、透析開始前に透析中血圧低下(20mmHg以下)の発生する確率をAUC0.91の高精度で予測し、さらに医師が経験的に設定した総除水量からコップ1杯程度の誤差で総除水量を予測するAIが開発できています。2023年4月にはPMDA開発前相談を終了しました。本AIをコアとするプログラム医療機器の実用化に向け開発を進めています。
2023年2月にAMEDの「医療機器開発推進研究事業(共同研究先の東北大学が研究代表機関)」に採択されました。2021年5月に、本AIの開発に関してニプロ株式会社と共同研究契約を締結しました。また、2023年12月に、東レ・メディカル株式会社と共同で血液透析における除水量や血流量の調節を制御する血液透析機器搭載型AIの開発に着手しました。
- 嚥下機能低下診断AIプログラム医療機器とは何ですか。
-
加齢に伴い口腔機能が低下する状態(オーラルフレイルといいます)を放置すると摂食障害や構音(発話)障害等多くの身体的、社会的障害、さらには全身性の筋肉虚弱(フレイル)につながるため、早期の診断と適切な処置が重要です。高齢社会において口腔機能低下のひとつである摂食嚥下障害は増加し、死因とされる肺炎の約7割が誤嚥によるとの報告もあります。誤嚥性肺炎の予防には嚥下機能低下の早期発見とリハビリテーション等の治療介入が重要ですが、現在では、嚥下内視鏡検査、嚥下透視検査方法等患者負担の大きい嚥下評価法しかありません。
嚥下と会話で使用する器官は舌や口腔・咽頭等共通部分が多く、会話から嚥下機能を評価できる可能性に着目し、嚥下機能障害を会話時の音声データから評価可能なAIを開発しています。東北大学の複数の診療科 (耳鼻咽喉科、歯科、医工学部リハビリテーション科)及び日本電気株式会社(NEC)と共同で、東北大学病院嚥下治療センターに受診する患者の話す音の全周波数を時系列データの分析に特化したAIエンジン(時系列モデルフリー分析)で解析することで、健常者の音声のベースライン(性差、年齢差、個人差等)を確認し、健常者の発音と患者の発音の違いを検出し、嚥下機能の低下を診断するAIが開発出来ています。
今後、嚥下機能低下を有する高齢者データで学習させることで、実用化に向け開発を進めます。本プログラム医療機器が実用化されれば、誤嚥性肺炎等を生じる可能性のある嚥下機能低下患者を簡便かつ早期に診断することができると期待されます。2023年3月に東北大学と共同で知的財産権を出願しました。
- 呼吸機能検査診断AIプログラム医療機器とは何ですか。
-
スパイロメトリーは呼吸機能生理検査で、被験者が吐き出す息の量と吐き出す時間を測定します。慢性閉塞性肺疾患(COPD)及びその他の肺の病気の診断に重要な検査ですが、その普及は進んでいません。 被験者(患者)の協力(努力呼吸)が必要である点に加えて、正しく検査が行えたかどうかを判定し、かつ出力された結果(フローボリューム曲線)を解釈することが非専門医には難しいためです。非専門医でも簡便に結果 を解釈できるシステムの開発は、呼吸器疾患を診断し、早期治療を行う上で重要な医療課題と考えられます。
フローボリューム曲線を解釈するAIを、京都大学及びNECソリューションイノベータ株式会社(NES)と共同で開発しています。約1,900症例の医療データを取得、実用化へ向けた開発を進めています。
2020年7月にチェスト株式会社と共同開発及び事業化に関する契約(ライセンス契約)を締結し、2021年10月及び2023年6月にチェスト社との契約に基づいてマイルストーンを受領しました。
- AIを活用したプログラム医療機器の開発は他にどんなプロジェクトがありますか。
-
重点領域の一つである女性の疾患に関する取組みとして、乳がんの病理画像から病変等を検出するAIを東北大学と共同で開発しています。病理画像を用いた検証では、検出モデルを3クラス(良性、非浸潤がん、浸潤がん)または2クラス(良性、悪性)で分類し、それぞれ88.3%と90.5%での診断精度を達成しました。今後、乳がん領域では「術中迅速病理検体」を用いたAI診断にも取り組む予定です。
また、老化関連疾患に関する取組みとして、心臓植込み型デバイスの情報を用いて、不整脈・心不全の発生予測をするAIを東北大学と共同で開発しています。
さらに、2022年9月に、株式会社ハイレックスコーポレーション及び株式会社ハイレックスメディカルとの共同研究契約を締結し、株式会社ハイレックスメディカル及び東北大学と共同で補助人工心臓の血栓発生を予測するAIの開発に取り組んでいます。
- 日本電気株式会社(NEC)及びNECソリューションイノベータ株式会社(NES)とはどのような共同研究を実施していますか。
-
AIを活用するプログラム医療機器は、コア技術であるAIとそれを医療現場で稼働させるためのシステム開発が必要です。解決すべき医療課題と活用する医療データの種類に基づいて、最適なAIアルゴリズムを選定する必要があります。当社は、いくつかの基本となるAIアルゴリズム(エンジン)を日本電気株式会社(NEC)からライセンスを受けて、医療現場で医療データや医師の助言で医療用にカスタマイズしています。開発した医療AIを医療現場で活用するためのシステムはNECソリューションイノベータ株式会社(NES)に委託して開発しています。
- ディスポーザブル極細内視鏡とは何ですか。
-
腹膜透析患者は透析液を注入するチューブを常に腹膜に挿入されていますが、当社は、この細いチューブを通して挿入し、開腹手術にも腹腔鏡にもよらず非侵襲的に腹腔内を観察する極細内視鏡(径1mm程度)を東北大学、順天堂大学、東京慈恵会医科大学と共同で開発しました。 2022年8月にはメイン部分のファイバースコープがPMDAに承認申請され、同年12月に厚生労働省から薬事承認されました。
付属品であるガイドカテーテル作成を含めた医療機器開発のために、2022年9月に株式会社ハイレックスコーポレーション及びその子会社である株式会社ハイレックスメディカルと共同研究契約を締結しました。
2024年5月に株式会社ハイレックスメディカルと、腹膜透析を含む医療用途について本内視鏡のライセンス契約を締結しました。
- フェニルケトン尿症診断薬とは何ですか。
-
フェニルアラニンは生体内タンパク質を構成するアミノ酸の1つで、体内で酵素によって代謝されてチロシンという別のアミノ酸に変わります。この酵素活性が生まれつき低いためにフェニルアラニンが代謝されずに体内に蓄積してしまう疾患がフェニルケトン尿症で、難病に指定されている小児疾患です。 この疾患は、適切な治療を行わないと知能発達遅延やけいれんなどの重篤な症状を出現します。1977年に生後マス・スクリーニング検査が実施され、ほぼ全ての患児が早期に発見されるようになりました。
しかし、患児はフェニルアラニンを制限するための食事療法を正しく行う必要があり、定期的な医療機関での検査が必要ですが、数か月に1度の採血では、きめ細やかな食事管理ができません。糖尿病患者のような自宅での血糖測定システムは無く、自己管理が難しい状況です。
当社は、自宅で簡便かつ正確に血中フェニルアラニン濃度を測定するシステムを東北大学と共同開発しています。この新規検査系をキット化し、自己管理の保険償還に繋げることを目的とします。糖尿病患者での自己血糖管理のように、家庭でいつでも自己測定が可能になれば、フェニルケトン尿症を有する患者のきめ細やかな食事管理が実現できます。
- 医療機器やプログラム医療機器の開発において何が重要ですか。
-
優れた技術があっても、医療現場の課題やニーズに合致していない、医療現場のスペックに不適切であるなどの理由から、医療応用(実用化)が難しい事例は多く、技術を有する多くの企業でもこの問題に直面しています。当社は、医療現場のニーズを出発点として問題の解決策を開発し、医療現場で最終製品をイメージして最適化開発を行い、イノベーションを実現する「バイオデザイン」という考えに基づいて医療機器やプログラム医療機器の開発を心掛けています。
決算・財務関連
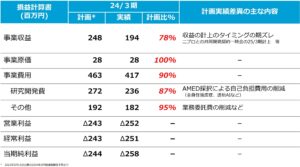
- 2024年3月期通期業績はどうでしたか。
-
2024年3月期の通期業績は、事業収益が194百万円、当期純損失が258百万円となりました。収益面については、企業との契約金に加え、国立研究開発法人日本医療研究開発機構(AMED)からの助成金が得られましたが、共同開発契約の一時金の計上タイミングが24年3月期から25年3月期に変更したことなどにより、計画比78%となりました。
また、費用面については、全身性強皮症に伴う間質性肺疾患や維持血液透析医療支援プログラム医療機器などのパイプライン開発において、AMEDからの公的資金を活用したことにより、当初計画に比べて当期純損失の額が縮小しました。
尚、自社の研究開発費は削減しましたが、当社の強みである効率的な研究開発活動を実施した結果、当初目標としていたパイプライン開発(数、ステージ)は予定通り進捗しています。
- 決算発表はいつですか。
-
第1四半期:8月中旬頃、第2四半期:11月中旬頃、第3四半期:2月中旬頃、決算発表:5月中旬頃 に行っております。
下記ページをご覧ください。
- 事業年度、決算期はいつですか。
-
事業年度は4月1日~翌年3月31日までであり、決算期は毎年3月です。
- 決算資料はどこで確認できますか。
-
下記ページをご覧ください。
- 過去の業績はどこで確認できますか。
-
下記ページをご覧ください。
- 現段階で黒字化の時期の目途はたっているのでしょうか。
-
安定的な黒字化を達成できる時期を明言することは難しいですが、単年度の黒字化につきましては数年のうちに達成できると考えております。その要因としては、パイプラインの導出から得られる収入(契約一時金、開発段階に応じて支払われるマイルストーン収入、製品の売上に応じて支払われるロイヤリティ収入等)が挙げられます。
株式・株主関連
- 株主の諸手続きに関する問い合わせ先はどこですか。
-
株式の諸手続きに関するお問い合わせは下記までお願いいたします。
三井住友信託銀行株式会社 証券代行部
電話番号 0120-782-031(フリーダイヤル)
※証券口座をお持ちの方は、お取引されている証券会社へお問い合わせをお願いいたします。
- 大株主の状況を教えてください。
-
下記ページをご覧ください。
- IRに関する問い合わせ先はどこですか。
-
下記ページから受付しています。
なお、多くいただきましたご質問には、当社ホームページ上のFAQなどで公開させていただきます。